Project 4
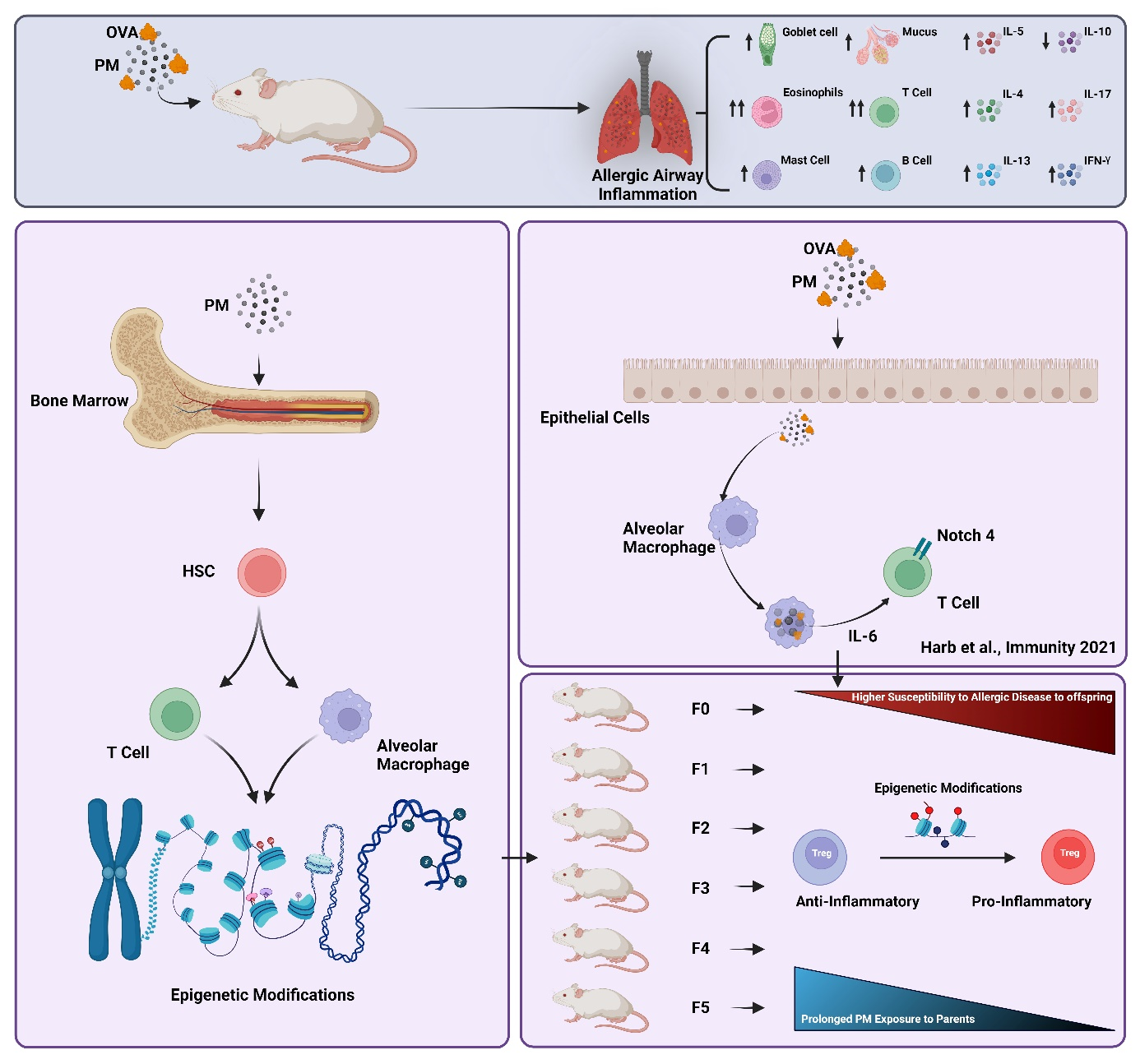
Die Asthma-Prävalenz hat in den letzten Jahrzehnten aufgrund von Urbanisierung und Änderungen des Lebensstils zugenommen. Die industriellen Revolutionen, die Ende des 19. Jahrhunderts begannen und sich im 20. und 21. Jahrhundert fortsetzten, haben zu einem massiven Anstieg der Feinstaubkonzentration (PM) in der Luft geführt. Dies hat zu einem Anstieg der Schwere und Prävalenz von Asthma an Orten geführt, die stark verschmutzt sind. Feinstaub fördert sowohl T-Helfer (Th) Typ 2 (Th2) als auch Typ 17 (Th17) Zellreaktionen und verursacht eine dramatische Hochregulierung der IgE-Produktion. Unsere jüngsten Studien haben einen molekularen Schalter zwischen Alveolarmakrophagen (AMs) und regulatorischen T-Zellen (Treg) identifiziert, die Jagged1 auf AMs und den Notch4-Rezeptor auf Treg-Zellen aktivieren. Epigenetische Modifikationen im Zusammenhang mit PM-induziertem Asthma und Langzeitwirkungen von Virusinfektionen nehmen zu. In dieser Studie wollen wir die Rolle von PM bei der Modifikation des Epigenoms T-Zellen untersuchen, indem wir Histonmodifikationen als eine der wichtigsten epigenetischen Markierungen für Veränderungen analysieren. Generationenübergreifende epigenetische Modifikationen von PM werden analysiert, um die langfristigen Auswirkungen der PM-Exposition in stark belasteten und sozioökonomisch schwachen Gemeinschaften und die möglichen Auswirkungen auf die Entwicklung und Verschlimmerung nicht übertragbarer Krankheiten zu verstehen. Maladaptives Immuntraining aufgrund von PM-Exposition wird weiter untersucht, indem hämatopoetische Stammzellen (HSC) mit T-Zell- und Treg-Funktionalität verknüpft werden. Darüber hinaus werden wir die Rolle weiblicher Keimbahn-Stammzellen (FGSC) bei der transgenerationalen epigenetischen Signalübertragbarkeit untersuchen. Diese Studie wird das Potenzial haben, neue Wege zu identifizieren, die von der PM-Exposition betroffen sind und als therapeutische Ziele gegen PM-abhängige epigenetische Modifikationen bei Asthma und anderen nicht übertragbaren Krankheiten verwendet werden können.
Asthma prevalence has increased in the past few decades due to urbanization and lifestyle changes. The industrial revolutions starting in late 19th century and continuing throughout the 20th and 21st centuries has caused a massive increase in particulate matter (PM) concentration in the air. This has led to an increase in asthma severity and prevalence in those places that are highly polluted. Particulate matter promotes both T helper (Th) type 2 (Th2) and type 17 (Th17) cell responses and cause a dramatic upregulation on IgE production. Our recent studies have identified a molecular switch between alveolar macrophages (AMs) and regulatory T (Treg) cells activating Jagged1 on AMs and Notch4 receptor on Treg cells. Epigenetic modifications related to both PM induced asthma and long effects of viral infections are on the rise. In this study, we want to investigate the role of PM in modifying the epigenome of T-cells by analyzing histone modifications as one main epigenetic mark for changes. Transgenerational epigenetic modifications of PM will be analyzed to understand the long-term effect of PM exposure in heavily polluted and low socioeconomically communities and the implications it may have on development and exacerbation of non-communicable diseases. Maladaptive immune training due to PM exposure will be further examined linking hematopoietic stem cells (HSC) with T-cell and Treg functionality. Furthermore, we will investigate the role of female germline stem cells (FGSC) in epigenetic signal transferability transgenerationally. This study will have the potential in identifying new pathways that are affected by the PM exposure and can be used as therapeutic targets against PM-dependent epigenetic modifications in asthma and other non-communicable diseases.